Абстрактный
Воздействие экологических и профессиональных токсикантов приводит к неблагоприятным последствиям для здоровья человека. Хелаторная терапия — единственная процедура, способная удалить токсичные металлы из органов и тканей человека, направленная на лечение повреждений, связанных с острой и/или хронической интоксикацией. В настоящем обзоре основное внимание уделяется последним данным об успешном использовании хелатирующего агента этилендиаминтетрауксусной кислоты (ЭДТА). Сообщается об оценке присутствия токсичных металлов в организме человека, а также обосновании терапии ЭДТА при сердечно-сосудистых и нейродегенеративных заболеваниях.
1. Введение
В настоящем обзоре рассматривается острое и хроническое лечение отравления токсичными металлами с помощью этилендиаминтетрауксусной кислоты (ЭДТА), а также клиническое значение других хелаторов токсичных металлов и хелаторов железа.
1.1 Влияние загрязнения окружающей среды на поступление металлов
Токсичные металлы могут вызывать многочисленные неблагоприятные последствия для здоровья человека. Люди могут подвергаться воздействию токсичных металлов, присутствующих в окружающей среде, несколькими путями, например, через дыхательные пути при вдыхании загрязненного воздуха [ 1 ] или перорально при употреблении загрязненной пищи и воды [ 2 ]. Воздействие окружающей среды представляет риск для здоровья населения в целом и, в частности, для некоторых профессиональных категорий.
1.1.1 Работники с высоким риском
Недавно связь между металлами в крови и воспалением была замечена у водителей такси [ 3 ]. У этих рабочих наблюдалось повышение концентрации ртути (Hg), мышьяка (As), свинца (Pb) и кадмия (Cd) в цельной крови по сравнению с контрольной группой; сывороточные маркеры воспаления, такие как интерлейкин 1 β , интерлейкин 6 и фактор некроза опухоли (TNF) α , показали рост. Уровни гомоцистеина у этих рабочих были значительно выше [гипергомоцистеинемия является известным фактором риска сердечно-сосудистых заболеваний (ССЗ)] [ 4 ], в то время как активность глутатионпероксидазы (GPX) и функция почек были нарушены. Эти результаты свидетельствуют о том, что Hg, As, Pb и Cd можно считать важными факторами, способствующими развитию ССЗ. В частности, уже была подчеркнута роль токсичности ртути в патогенетических механизмах гипертонии, атеросклероза, ишемической болезни сердца, инфаркта миокарда, сердечных аритмий, вариабельности сердечного ритма, внезапной смерти, нарушений мозгового кровообращения, заболеваний сонных артерий, почечной дисфункции и общей смертности [ 5 ]. Общий механизм повреждения, вызванного токсичными металлами, по-видимому, обусловлен индукцией окислительного стресса. Окислительный стресс провоцируется несбалансированными окислительно-восстановительными состояниями, включающими либо избыточную генерацию активных форм кислорода (ROS), либо дисфункцию антиоксидантной системы. Например, Pb и Cd имеют высокое сродство к группам –SH в ферментах антиоксидантной системы защиты, таких как супероксиддисмутаза (SOD), каталаза (CAT), GPX и глюкозо-6-фосфатдегидрогеназа (G6PD), и впоследствии подавляют их активность. Помимо воздействия на группы -SH, Pb и Cd, как двухвалентные катионы, могут также замещать двухвалентные биоэлементы, которые служат важными кофакторами антиоксидантных ферментов, таких как GPX, SOD и CAT, что приводит к их инактивации. Также было подтверждено, что оба металла влияют на уровень глутатиона (GSH), трипептида, который содержит более 90% нетканевой серы в организме человека, представляя собой один из важнейших компонентов антиоксидантной защиты. Таким образом, и Pb, и Cd вызывают образование ROS и истощение антиоксидантной защитной системы [ 6 ].
Была изучена еще одна профессиональная категория — рабочие коксовых печей: у этих субъектов было продемонстрировано взаимодействие тяжелых металлов (As, Cd, хрома или Cr, никеля или Ni и Pb) и полициклических ароматических углеводородов, которое увеличивает окислительный стресс [ 7 ]. Кроме того, было замечено, что воздействие соединений Pb на человека вызывает увеличение печени и активирует воспалительные реакции, характеризующиеся умеренным холестазом в желчных протоках; эти состояния более очевидны у субъектов с более высокими уровнями воздействия Pb [ 8 ].
1.1.2 Токсичность в зависимости от географических зон
В целом, искусственные химикаты, включая ксеноэстрогены, пестициды, кроме тяжелых металлов, и нездоровый образ жизни, в основном курение табака, употребление алкоголя и злоупотребление медицинскими препаратами, считаются основными факторами, вызывающими плохое пренатальное развитие из-за генерации ROS и клеточного окислительного повреждения [ 9 ]. Риски, связанные с воздействием токсичных металлов, различаются в зависимости от географического положения. Действительно, в некоторых районах токсикологические риски для здоровья кажутся выше, чем в других: на Гаити грунтовые воды показывают загрязнение Pb и Cr [ 10 ], тогда как значительные уровни As, Pb, Cd, Ni и Cr были обнаружены в съедобных тканях рыбы в дельте реки Чжуцзян в Китае [ 11 ]. Кроме того, загрязнители окружающей среды, например, токсичные металлы, такие как алюминий (Al), считаются возможной причиной болезни Альцгеймера [ 12 ].
1.1.3 Влияние на беременность и детство
Воздействие тяжелых металлов во время беременности потенциально вредно для развивающегося плода. Недавнее исследование было сосредоточено на пренатальном загрязнении путем изучения концентраций Pb, Hg и Cd в образцах крови новорожденных (образец пуповинной крови был взят сразу после рождения), беременных женщин и их партнеров в Мадридском автономном регионе [ 13 ]. В другом исследовании, проведенном на беременных женщинах, проживающих в Восточном Китае, образцы материнской крови и мочи были получены в третьем триместре беременности [ 14 ]. Изучался парентеральный перенос Cd, Hg и Pb путем их обнаружения в образцах материнской и пуповинной крови (плазма и эритроциты), а также в образцах постнатальной крови некоторых пар афроамериканских матерей и младенцев, случайно выбранных из когорты рождений в Бостоне [ 15 ]. Эти работы подтверждают, что табачный дым и потребление рыбы являются важными предотвратимыми источниками воздействия тяжелых металлов на новорожденных.
1.2 Воздействие на органы и системы
После воздействия токсичных металлов могут быть повреждены многие органы и/или системы организма [ 16 ]. Основными органами-мишенями элементарной ртути являются мозг и почки [ 17 ]. Воздействие Cd в детском возрасте, по-видимому, отрицательно влияет на функцию почек в сельской местности Бангладеш [ 18 ]. Было показано, что воздействие As, Cd, Pb и Hg оказывает некоторые пагубные эффекты на гематологическую систему [ 19 ]. Pb и Cd влияют на кровь, печень и почки, вызывая окислительный стресс [ 6 ]. Кроме того, поскольку мозг является органом, который особенно уязвим к воздействию ROS из-за его потребности в кислороде и обилия липидных клеток, восприимчивых к переокислению, роль ROS в патофизиологии нейродегенеративных заболеваний (ND) представляется центральной [ 20 ].
1.3 Воздействие на клетки
Сообщалось о многих опасных эффектах токсичных металлов на клеточном уровне человека. Действительно, известно, что Pb изменяет состав мембран фосфолипидов в эритроцитах человека, ингибирует трансметилирование и усиливает перекисное повреждение фосфолипидов [ 21 ]. Нейродегенерация, вызванная Pb, была протестирована на нейрональных клетках PC12, в которых развивался окислительный стресс и апоптоз, усугубленный соэкспозицией этанола [ 22 ]. Повреждение Pb на клетках PC12 распространялось на соседние клетки через ROS-митохондриальную апоптотическую сигнализацию через щелевые соединения между клетками [ 23 ]. Также сообщалось об изменениях, вызванных тяжелыми металлами, в межклеточных соединениях почек [ 24 ].
Учитывая серьезный ущерб здоровью человека, наносимый воздействием токсичных металлов, следует изучить, как можно определить это загрязнение в организме человека.
2. Оценка присутствия токсичных металлов в организме человека
Масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС) — это метод, который в настоящее время используется для оценки уровней токсичных металлов в образцах крови и/или мочи у людей. Тот же метод эффективно использовался для оценки концентраций металлов в образцах волос [ 25 ].
После «острой» интоксикации определение токсичных металлов в образцах крови и мочи представляет собой полезный инструмент для оценки наличия таких металлов в организме человека. Была обнаружена сильная корреляция между Cd в почках и Cd в моче и крови у популяции, подвергшейся воздействию окружающей среды [ 26 ]. Как сообщалось для видов Hg, крысы, подвергшиеся воздействию тимеросала или метилртути через зонд, показали высокий уровень общей ртути в крови, который постепенно снижался от 6 до 120 часов после воздействия. Ткани, собранные на пятый день после воздействия, показали различные формы Hg (неорганическая, метилртуть или этилртуть) в мозге, печени, сердце и почках [ 27 ]. Однако увеличение значений токсичных металлов в крови отражает только недавнее острое воздействие, как это было отмечено для Pb [ 28 ]. Токсичные металлы быстро перемещаются из крови во многие ткани, где они распределяются, например, в центральную нервную систему (ЦНС). Накопленные металлы могут оставаться там в течение многих лет, отрицательно влияя на функцию клеток и тканей. Для удаления секвестрированных токсичных металлов из крови (где токсичные металлы накапливаются после острого воздействия) или органов человека (где те же металлы накапливаются после хронического воздействия) единственный способ — это связать такие металлы с хелатирующими агентами с целью образования комплексов. Способы введения — пероральный, внутримышечный (IM) и внутривенный (IV). Комплексы могут выводиться, в частности, почками. Действительно, уровни токсичных металлов можно исследовать в образцах мочи, собранных у пациентов, после «пробы» с подходящим хелатирующим агентом.
После определения наличия токсичных металлов из-за острого или хронического воздействия возникает второй вопрос: как можно удалить эти загрязняющие токсичные металлы? Наиболее эффективными способами снова кажутся пероральное, внутримышечное или внутривенное введение хелатообразующих агентов для содействия выведению токсичных металлов с мочой или калом через желчь. Хелатотерапия играет центральную роль в современной медицине и фармакологии. Непрерывные исследования с лабораторными животными и обширный клинический опыт показывают, что острая или хроническая интоксикация различными металлами может быть значительно улучшена путем введения подходящего хелатообразующего агента [ 29 ]. Поскольку ЭДТА способна связывать Fe +++ , но не Fe ++ [ 30 ], в этом обзоре мы рассмотрели хелаторы, способные удалять избыток железа из-за клинических последствий его перегрузки, а также с учетом роли Fe в нейродегенерации.
3. Хелатирующие агенты
3.1 Избыток железа (Fe) при талассемии и ND
Острая интоксикация железом успешно лечилась хелатной терапией с использованием дефероксамина. Женщину, которая приняла сульфат железа при попытке самоубийства, лечили специфическим хелатором железа дефероксамином, который связывает трехвалентное железо, образуя водорастворимое соединение, которое быстро выводится почками, вызывая изменение цвета мочи [ 31 ]. Важные проблемы, связанные с хронической перегрузкой железом, наблюдаемые у пациентов с талассемией, можно преодолеть с помощью хелатирующих агентов, таких как деферипрон, деферазирокс и дефероксамин [ 32 ]. Недавно было показано, что комбинированное лечение пероральным деферипроном и подкожным десфероксамином два раза в неделю является безопасной и эффективной альтернативой монотерапии хелатированием у детей с бета-талассемией, зависящей от переливания крови [ 33 ]. Сообщалось об использовании комбинированных хелаторов железа для профилактики кардиомиопатии, связанной с перегрузкой железом при талассемии [ 34 , 35 ]. Более того, деферипрон считается аналогичным дефероксамину в лечении промежуточной талассемии [ 36 ]. Кроме того, было показано, что пероральный хелатор железа деферазирокс способен ингибировать транскрипцию, зависимую от NF- (ядерного фактора-) kB, не влияя на ее проксимальную активацию, что приводит к снижению продукции TNF из Т-клеток, стимулированных in vitro. Эти результаты предполагают, что улучшение кроветворения, наблюдаемое у пациентов, получавших лечение деферазироксом, страдающих миелодисплазией и апластической анемией, может отражать противовоспалительный эффект, опосредованный ингибированием фактора транскрипции NF-kB, и поддерживать терапевтическое нацеливание на этот путь [ 37 ].
В настоящее время накоплено много доказательств относительно участия Fe в различных ND, а также потенциальной терапии с использованием хелаторов Fe для замедления их прогрессирования [ 38 ]. С возрастом наблюдается повышение уровня Fe в мозге (в ферритине и нейромеланине) без явных неблагоприятных эффектов в лобной коре, хвостатом ядре, скорлупе, черной субстанции и бледном шаре. Однако избыточное количество Fe в этих конкретных областях или в определенных внутриклеточных отсеках мозга приводит к ND. Действительно, окислительно-восстановительно-активные ионы металлов, такие как Fe и медь (Cu), могут вызывать окислительный стресс посредством образования ROS и видов азота. Одноэлектронное восстановление H 2 O 2 с помощью Fe 2+ (хорошо известная реакция Фентона) производит Fe 3+ и гидроксильный радикал OH ∙ , который может реагировать с большим количеством клеточных компонентов. Это приводит к неправильному сворачиванию белка, образованию амилоида и образованию нерастворимых белковых агрегатов, содержащихся в тельцах включения. Нарушение регуляции метаболизма Fe, связанное с повреждением клеток и окислительным стрессом, сообщается как распространенное явление при болезни Альцгеймера (БА) и болезни Паркинсона (БП) [ 39 ]. Это активирует микроглию, приводя к нейровоспалению, которое играет важную роль в прогрессировании НД, поскольку активированная микроглия выделяет провоспалительные цитокины, которые могут повреждать нейронные клетки. Доказательства участия металлов в БП и БА, а также атаксии Фридрейха и рассеянном склерозе (РС) предполагают изучение эффектов хелаторов Fe у пациентов, страдающих этими заболеваниями [ 38 ]. Гомеостаз Fe в мозге все чаще признается потенциальной целью для разработки лекарственной терапии при возрастных расстройствах. Деферипрон немного улучшил двигательные симптомы у пациентов с болезнью Паркинсона после 12 месяцев лечения, в то время как содержание железа в черной субстанции значительно снизилось при оценке с помощью магнитно-резонансной томографии (МРТ) [ 40 ].
Избыточное количество Fe может быть токсичным, и его накопление у пациентов с РС, как правило, считается пагубным. Однако Fe поддерживает целостность олигодендроцитов и миелина и способствует их регенерации после травмы. Внеклеточный матрикс, ключевой регулятор ремиелинизации, также может регулировать уровни Fe. Гистологические и МРТ-исследования изучали изменения в распределении Fe, связанные с РС. Лечение, нацеленное на Fe у пациентов с РС, должно уравновешивать трофические и токсические свойства Fe, обеспечивая достаточные уровни Fe для ремиелинизации и восстановления, избегая при этом излишков, которые могут подавить гомеостатические механизмы и способствовать повреждению [ 41 ]. У пациентов с РС была подчеркнута роль Fe в нейродегенерации, что предполагает использование хелаторов Fe вместе с ингибиторами нейровоспаления [ 41 ].
3.2 Избыток токсичных металлов
Токсичные металлы, которые чаще всего вызывают нагрузку на человека, — это Pb, Al, Hg, Cd, As и Ni.
Другие менее распространенные токсичные металлы: сурьма (Sb), барий (Ba), бериллий (Be), висмут (Bi), цезий (Cs), гадолиний (Gd), палладий (Pd), платина (Pt), теллур (Te), таллий (Tl), торий (Th), олово (Sn), вольфрам (W) и уран (U); Cr является канцерогенным тяжелым металлом, ответственным за повреждение ДНК и мутации [ 42 ]. В таблице 1 приведены (для каждого токсичного металла) целевые органы и/или аппараты, источники токсичных металлов (которые всегда представлены приемом внутрь, вдыханием или кожной абсорбцией; следует отметить, что гадолиний, когда используется в качестве контрастного вещества, и платина, когда используется в качестве химиотерапевтического средства, могут вводиться внутривенно), и токсические дозы каждого металла. В таблице 2 приведены наиболее важные симптомы и заболевания интоксикации.
Таблица 1.
Сообщается о целевых органах/аппаратах, источниках и уровнях токсичности для каждого токсичного металла.
| Основные органы-мишени или аппараты | Основной путь ассимиляции | Токсичные уровни мкг /г креатинина |
|||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Почка | СНС | Печень | Желудочно-кишечная система | Дыхательная система | Кожа | Сердечно-сосудистая/кроветворная система | Слизистая оболочка полости рта/носа | Опорно-двигательная система | Проглатывание (П) Вдыхание (ВВ) Поглощение через кожу (ПА) |
||
| Алюминий | х | х | х | Я, ИХ | 35,00 | ||||||
| Сурьма | х | х | х | х | х | х | Я, ИХ, ДА | 0,30 | |||
| Мышьяк | х | х | х | х | х | х | Я, ИХ | 108,00 | |||
| Барий | х | х | х | х | х | Я, ИХ | 7,00 | ||||
| Бериллий | х | х | х | х | Я, ИХ | 1,00 | |||||
| Висмут | х | х | х | х | х | х | х | Я, ИХ, ДА | 10,00 | ||
| Кадмий | х | х | х | х | х | х | х | Я, ИХ | 0,80 | ||
| Цезий | х | х | х | х | х | х | х | Я, ИХ, ДА | 9,00 | ||
| Гадолиний | х | х | х | я | 0,30 | ||||||
| Вести | х | х | х | х | х | х | Я, ИХ, ДА | 2,00 | |||
| Меркурий | х | х | х | х | х | х | х | Я, ИХ, ДА | 3,00 | ||
| никель | х | х | х | х | х | Я, ИХ, ДА | 10,00 | ||||
| Палладий | х | х | Я, ДА | 0,30 | |||||||
| Платина | х | х | х | ИХ, ДА | 1,00 | ||||||
| Теллур | х | х | х | х | Я, ИХ | 0,80 | |||||
| Таллий | х | х | х | х | Я, ИХ | 0,50 | |||||
| Торий | х | х | х | Я, ИХ | 0,03 | ||||||
| Олово | х | х | х | Я, ИХ, ДА | 9,00 | ||||||
| Титан | х | х | х | х | х | Я, ИХ, ДА | 15,00 | ||||
| Вольфрам | х | х | х | Я, ИХ | 0,40 | ||||||
| Уран | х | х | х | х | х | х | Я, ИХ, ДА | 0,03 | |||
Таблица 2.
Наиболее распространенные симптомы и/или заболевания, развивающиеся после интоксикации, сообщаются для каждого токсичного металла. Это свободный постредактирование от Чжоу и др. [ 16 ].
| Симптомы и заболевания | |
|---|---|
| Алюминий | Усталость, гипофосфатемия, увеличение протромбинового времени и порфирия. |
| Сурьма | Тошнота, анорексия, металлический привкус, усталость и мышечная слабость. Гипотония, сердечная боль (как стенокардия) и неправильная поляризация желудочков. Раздражение дыхательных тканей, пневмокониоз. «Пятна сурьмы» на коже. |
| Мышьяк | Усталость, недомогание. Экзема или аллергический дерматит. Гипопигментация кожи, белые полоски на ногтях, выпадение волос и стоматит. Повышенное слюноотделение и чесночный запах изо рта. Периферическая невропатия. Повреждение миокарда, гемолиз и апластическая анемия с лейкопенией. |
| Барий | Покалывание в конечностях, аномальные рефлексы и паралич. Рвота, диарея. Аритмия, гипертония. Остановка дыхания/недостаточность. |
| Бериллий | Гипопротеинемия, анемия. Повреждение печени и почек. Боль в груди, кашель и усталость. Гранулематозный, заболевание легких, рак легких. |
| Висмут | Запор или нарушение стула, колит. Неприятный запах изо рта. Изменения пигментации кожи и десен (сине-черные), гингивит и стоматит. Эритема и язвы кожи, раздражение слизистых оболочек. Нефрит, нефроз и гепатит. «Висмутовая энцефалофия» со спутанностью сознания, неуклюжестью, миоклоническими подергиваниями, тремором и дизартрией (остеоартропатия). |
| Кадмий | Гипертония. Микроцитарно-гипохромная анемия (не поддающаяся лечению добавками железа). Протеинурия с аномально высокой экскрецией бета-2-микроглобулина. |
| Цезий | Желудочковые аритмии, кардиотоксичность. Головная боль, тошнота и эпилептические припадки. |
| Гадолиний | Спазмы в животе, диарея. Вялость, мышечные спазмы и респираторный коллапс. Раздражение кожи и глаз. |
| Вести | Потеря аппетита, запор. Слабый синтез гемоглобина, анемия. Нефротоксические эффекты с нарушением почечной экскреции мочевой кислоты. Тремор, нейропатия и энцефалопатия. |
| Меркурий | Снижение осязания, слуха, зрения и вкуса, металлический привкус во рту. Усталость или отсутствие физической выносливости. Повышенное слюноотделение. Анорексия, онемение и парестезии, головные боли, раздражительность и возбудимость. Тремор и нарушение координации, психозы и маниакальное поведение. Анемия. Гипертония. |
| никель | Головная боль, головокружение. Мышечная слабость. Тошнота, рвота. Сердцебиение. Зуд кожи и дерматит, экзема. Паналлергия с астмой, конъюнктивитом, ринитом и синуситом. |
| Палладий | Раздражение кожи, глаз и дыхательных путей, а также аллергический контактный дерматит. |
| Платина | Тошнота, рвота. Одышка и хрипы. Дерматит, развитие хронических аллергических реакций («платиноз»). Нефроз. Анемия, тромбоцитопения и лейкопения. |
| Теллур | Раздражение глаз и дыхательных путей. Сонливость, головная боль. Сухость во рту, металлический привкус, чесночный запах дыхания, пота и мочи. Боль в животе, тошнота, рвота и анорексия. Угнетение дыхания. Коллапс кровообращения. Синеватые/черные пятна на коже. |
| Таллий | Тошнота, желудочно-кишечные расстройства, диарея и потеря веса. Протеинурия. Усталость. Спутанность сознания, потеря памяти, психозы и периферические неврологические признаки: парестезии, миалгии, тремор и атаксия. Выпадение волос с сохранением лобковых и телесных волос и латеральной части бровей, алопеция. |
| Торий | Респираторный дистресс и пневмония, легочная гипертензия и фиброз. |
| Олово | Снижение обоняния, головная боль, утомляемость, атаксия и мышечная слабость. Раздражение контактных тканей (глаз, кожи, бронхов или желудочно-кишечного тракта). |
| Титан | Стеснение в груди и затрудненное дыхание. Раздражение кожи глаз. Нейровоспаление наночастицами диоксида титана. Реакция гиперчувствительности. |
| Вольфрам | Заболевания легких (пневмокониоз, рак). Экзема, зуд, фолликулит и нейродермит. |
| Уран | Усталость. Выпадение волос, алопеция и дерматит. Повышенная двигательная активность. Нарушение цикла сон-бодрствование, снижение памяти и повышенная тревожность. |
3.3 Хелатирующие агенты
В прошлом для устранения интоксикации металлами использовались многие агенты, такие как пеницилламин, британский антилюизит (BAL или димеркапрол), 2,3-димеркапто-1-пропансульфоновая кислота (унитиол, DMPS) и мезо-2,3-димеркаптоянтарная кислота (сукцимер, DMSA), кроме EDTA. D-пеницилламин использовался для удаления Hg, Pb и Cd, кроме Cu, в избытке [ 43 ] и в сочетании с DMPS при болезни Вильсона [ 44 ]. BAL использовался для лечения отравления тяжелыми металлами. В случаях отравления элементарными и неорганическими солями ртути BAL можно вводить внутримышечно. DMSA и DMPS вводятся перорально или с помощью внутривенной инъекции и в настоящее время используются в качестве хелатирующих агентов при отравлении ртутью [ 45 ].
Человеческое бремя всех зарегистрированных токсичных металлов может быть выявлено с помощью хелатирующего агента ЭДТА, используя так называемый «тест на хелатирование». В качестве кислоты ЭДТА (этилендиаминтетрауксусная кислота) использовалась в клинической офтальмологии для лечения полосчатой кератопатии [ 46 ]. В современной клинической практике она существует как эдетат натрия (Na2EDTA ) и как динатрийэдетат кальция (CaNa2EDTA ) , который часто сообщается как CaEDTA. «Провокация» с ЭДТА или «тест на хелатирование» подчеркивает наличие токсичных металлов в образцах мочи, полученных от пациентов. Пациентам предлагается собирать образцы мочи до и после внутривенного лечения хелатирующим агентом CaNa2EDTA ( 2 г/10 мл, разведенных в 500 мл физиологического раствора), называемого в настоящей статье ЭДТА. ЭДТА медленно вводится внутривенно (инфузия длится около 2 часов), а время сбора мочи после хелатирования составляет 12 часов. Содержание токсичных металлов в моче выражается в микрограммах ( мкг ) на г креатинина [ 47 ]. Подробности относительно «теста на хелатирование» уже были опубликованы [ 48 ].
3.4. Полезность ЭДТА как хелатирующего агента в клинической практике
Следующие случаи, описанные в литературе, подтверждают полезность ЭДТА в клинической практике. В 1997 году в сельской Албании было зарегистрировано тяжелое отравление людей свинцом. Двадцать три человека с признаками свинцовой интоксикации выздоровели после интенсивной хелатирующей терапии CaEDTA [ 49 ]. Хелатирующая терапия ЭДТА использовалась французскими исследователями совместно с исследователями из США для удаления загрязняющих металлов и снижения образования свободных радикалов у людей, как сообщалось в исследовании, опубликованном в 2005 году [ 50 ]. Авторы показали, что добавление высокой дозы (5 г) витамина С к хелатирующим растворам ЭДТА вызывало острый прооксидантный эффект, который отслеживался с помощью окислительных маркеров липидов, белков и ДНК, но что длительное лечение (например, несколько сеансов хелатирующей терапии ЭДТА) защищало от окислительного повреждения, несмотря на присутствие витамина С. Более того, в 2009 году французская группа показала, что хелатирующая терапия ЭДТА без добавления витамина С снижала окислительное повреждение ДНК и перекисное окисление липидов [ 51 ]. CaEDTA использовался для предотвращения повреждений от острого отравления свинцом у младенца, который получал традиционную оманскую медицину (которая, как было обнаружено, содержала большое количество Pb) от запора [ 52 ]. Успешное лечение с помощью ЭДТА крайне острой интоксикации свинцом у ребенка было проведено в Словацкой Республике [ 53 ]. Совсем недавно в Италии хелатирование с помощью ЭДТА успешно применялось для лечения четырех пациентов, подвергшихся профессиональному отравлению на двух китайских заводах по переработке аккумуляторов [ 54 ]. Использование CaEDTA, а не Na2EDTA , кажется более безопасным при лечении детей с интоксикацией свинцом [ 55 ]. Хелатная терапия CaEDTA использовалась для устранения интоксикации Cd в сочетании с восстановленным глутатионом (GSH) [ 56 ]. GSH играет ключевую роль в устойчивости клеток к окислительному повреждению, обеспечивая ферменты, участвующие в метаболизме ROS, восстанавливающими эквивалентами, устраняя потенциально токсичные продукты окисления и восстанавливая окисленные тиолы белков [ 57 ]. Недавно мы показали, что лечение CaNa2EDTA пациентов , страдающих от нагрузки Al, значительно снижает интоксикацию Al [ 48 ]. Более того, была показана эффективность долгосрочной хелатной терапии при устранении хронической интоксикации Al [ 58 ]. В таблице 3 приведены наиболее важные клинические характеристики хелатирующих агентов. EDTA в дозе 2 г/неделю при медленной внутривенной инфузии (в течение примерно 2 часов) не вызывала побочных эффектов у людей. В прошлом при использовании Na 2 EDTA в дозе 6 г/неделю наблюдалось увеличение паратиреоидного гормона и снижение сывороточной костной щелочной фосфатазы [ 59]. По моему опыту, при дозировке 2 г один раз в неделю ЭДТА не имеет побочных эффектов.
Таблица 3.
Характеристика хелатирующих агентов, используемых в клинической практике.
| Способ применения | Доза для взрослых | Путь выведения металлокомплексов | Побочные эффекты | |
|---|---|---|---|---|
| БАЛ | Я | 5 мг/кг/день | Моча, желчь, кал, легкие | Тошнота, рвота, гипертония, тахикардия, головная боль |
|
|
||||
| Деферипрон | Оральный | 50–100 мг/кг/день | Моча | Токсичность ЦНС, хрусталиковые помутнения, артропатия |
|
|
||||
| Дефероксамин | IV | 50 мг/кг/день | Моча | Тошнота, потеря веса, токсичность для глаз |
| Подкожно | 20 мг/кг/день | |||
|
|
||||
| Деферазирокс | Оральный | 35 мг/кг/день | Фекалии, моча | Боль в животе, тошнота, рвота, повышение уровня печеночных ферментов |
|
|
||||
| ДМПС | Оральный | 300 мг три раза в день | Моча | Сыпь, тошнота, лейкопения |
| IV | до 1500 мг/день | |||
| Я | 20 мг/кг/день | |||
|
|
||||
| ДМСА | Оральный | 30 мг/кг/день | Моча, желчь, кал, легкие | Желудочно-кишечные расстройства (ЖКТ), кожная сыпь, гриппоподобные симптомы |
| IV | 10 мг/кг три раза в день | |||
|
|
||||
| ЭДТА | IV | 2 г/неделю | Моча | Нет ∗ |
|
|
||||
| Д-пеницилламин | Оральный | 5–20 мг/кг/день | Моча | Дегенеративная дермопатия, тромболейкопения, ЖКТ |
∗ При применении один раз в неделю в указанной дозе и внутривенном введении примерно в течение 2 часов.
DMPS: 2,3-димеркапто-1-пропансульфоновая кислота.
ДМСА: мезо-2,3-димеркаптосукциновая кислота.
ЭДТА: CaNa2 этилендиаминтетрауксусная кислота.
4. Полезность хелатной терапии с ЭДТА при сердечно-сосудистых заболеваниях (ССЗ) и нейродегенеративных заболеваниях (НД)
4.1.Сердечно-сосудистые заболевания
Na 2 EDTA считается более способным хелатировать Ca ++, чем CaNa 2 EDTA, и используется для лечения атеросклероза, хронического воспаления, связанного с эндотелиальной дисфункцией, поскольку считается, что EDTA действует, удаляя кальций из жировых бляшек. Действительно, терапия хелатирования EDTA с использованием Na 2 EDTA использовалась в прошлом и используется до сих пор для лечения пациентов с ишемической болезнью сердца [ 60 ].
Недавнее исследование показало, что у стабильных пациентов, перенесших инфаркт миокарда, сочетание пероральных высоких доз витаминов и хелатирующей терапии ЭДТА по сравнению с двойным плацебо снизило клинически важные сердечно-сосудистые события до степени, которая была как статистически значимой, так и потенциально клинической значимости [ 61 ]. Содержимое инфузии хелатирования содержало различную дозу этилендиаминтетрауксусной кислоты до максимальной 3 г в зависимости от расчетной скорости клубочковой фильтрации и было основано на Na2ЭДТА . Был проведен режим из 40 инфузий [ 62 ]. Результаты этого клинического исследования (которое показало, что хелатор металлов снижает сердечно-сосудистые события) подчеркивают потенциальную связь между загрязнителями металлов и сердечно-сосудистыми заболеваниями. Действительно, было показано, что Hg, Pb, Cd и As демонстрируют эпидемиологические и механистические связи с атеросклерозом и сердечно-сосудистыми заболеваниями, что позволяет предположить, что загрязнение окружающей среды металлами может быть мощным и изменяемым фактором риска атеросклеротического заболевания [ 63 ]. Эпидемиологические данные свидетельствуют о том, что воздействие Cd и As связано с заболеваемостью и смертностью от сердечно-сосудистых заболеваний [ 63 , 64 ]. Сахарный диабет является хорошо известным фактором риска раннего развития сердечно-сосудистых заболеваний. Хелатирование EDTA влияет как на переходные, так и на токсичные металлы. Фактически, переходные металлы, такие как Cu и Fe, играют важную роль в пути окислительного стресса, который участвует в резистентности к инсулину, тогда как металлы Pb и Cd особенно токсичны для сердечно-сосудистой системы. Поэтому недавние результаты исследований предполагают использование хелатирования EDTA при лечении сердечно-сосудистых заболеваний, особенно у пациентов с диабетом [ 65 ].
4.2.НД
Роль пренатального и постнатального воздействия факторов окружающей среды может привести к возникновению ND в более позднем возрасте. Нейротоксичные металлы, такие как Pb, Hg, Al, Cd и As, а также некоторые пестициды и наночастицы на основе металлов, были вовлечены в AD из-за их способности увеличивать бета-амилоидный пептид и фосфорилирование белка тау, вызывая сенильные амилоидные бляшки и нейрофибриллярные клубки, которые характерны для AD. Воздействие Pb, марганца (Mn), растворителей и пестицидов было связано с определенными признаками PD, такими как митохондриальная дисфункция, изменения в гомеостазе металлов и агрегация белков альфа-синуклеина, ключевого компонента телец Леви, которые являются решающим фактором в патогенезе PD [ 66 ]. Хроническое воздействие метил-Hg вызывает симптомы, похожие на те, которые наблюдаются при боковом амиотрофическом склерозе (ALS) и AD. Действительно, Hg и ее соли способны вызывать истощение GSH, разрушение митохондрий и повышенное перекисное окисление липидов белка и ДНК в мозге [ 67 ]. Хелатная терапия с ЭДТА, польза которой была показана при устранении интоксикации Al [ 48 ], может быть, следовательно, рекомендована для удаления других токсичных металлов, ответственных за развитие ND. Благоприятный эффект лечения с ЭДТА был продемонстрирован путем неврологического облегчения таких симптомов, как спастичность, утомляемость и рецидив у пациентов, отравленных Al и страдающих ND [ 48 , 58 , 68 ]. Было показано, что ЭДТА полезна для ослабления повреждения периферических клеток крови у рабочих, подвергшихся воздействию Pb [ 69 ]. Был продемонстрирован терапевтический эффект ЭДТА в экспериментальных моделях рассеянного склероза, где ЭДТА смогла уменьшить бляшки демиелинизации у мышей, которым вводили препарат внутрибрюшинно, возможно, в связи с антиоксидантным и противовоспалительным действием ЭДТА [ 70 ].
5. Защита почек при лечении ЭДТА
Случаи острого некроза канальцев были зарегистрированы после раннего клинического использования ЭДТА с использованием очень больших доз [ 71 ]. В дозах, используемых в настоящее время в клинической практике, ЭДТА эффективно задерживает прогрессирование хронической болезни почек у пациентов с измеримым содержанием свинца в организме, что отражается в повышенных уровнях расчетной скорости клубочковой фильтрации и скорости клиренса креатинина [ 71 ].
Было показано, что лечение ЭДТА замедляет прогрессирование экспериментальной нефропатии свинца [ 72 ]. Действительно, почечные изменения, вызванные у самцов крыс Wistar во время хронического отравления свинцом, показали гипертрофию и вакуолизацию средних и мелких артерий; мукоидный отек и мышечную гипертрофию в артериолах; потерю клеточных щеточных каемок, потерю клеток и внутриклеточных включений в проксимальных канальцах; фиброз и наличие инфильтратов в интерстициальных компонентах. У крыс, получавших лечение интраперитонеально в течение пяти дней с помощью CaNa2 ЭДТА , такие изменения были отсрочены. Ранее мы продемонстрировали эффективность лечения ЭДТА в улучшении функции почек в экспериментальной модели почечной ишемии/реперфузии (И/Р) [ 73 ]. И/Р почек представляет собой эндотелиальное повреждение, подобное тому, что происходит при ишемической болезни сердца. Более того, такая защита почек была показана у людей. Во многих работах положительно описывается клинически пролонгированное лечение ЭДТА у пациентов , страдающих хроническими заболеваниями почек (с диабетом или без него), после или без интоксикации свинцом [ 74–78 ]. Более конкретно, исследователи показали, что (i) низкоуровневое воздействие свинца в окружающей среде может ускорить прогрессирующую почечную недостаточность у пациентов без диабета, страдающих хроническим заболеванием почек; (ii) низкоуровневое воздействие свинца в окружающей среде ускоряет прогрессирующую диабетическую нефропатию, а терапия хелатированием свинца может снизить скорость ее прогрессирования у пациентов с диабетом II типа; (iii) повторная терапия хелатированием может улучшить функцию почек и замедлить прогрессирование почечной недостаточности у пациентов, не страдающих диабетом. Другие токсичные металлы, такие как Cd, Cr, Hg и U, ранее были связаны с нефропатией [ 79 ]. Примечательно, что все эти металлы хелатируются ЭДТА.
6. Прохождение ЭДТА через гематоэнцефалический барьер
Некоторые авторы утверждают, что ЭДТА не может пересекать гематоэнцефалический барьер. Прохождение через гематоэнцефалический барьер физиологически возможно в околожелудочковые органы. Однако сообщалось о новых концепциях транспорта молекул и клеток (воспалительных и неопластических) при воспалительных состояниях [ 80 ]. Совсем недавно были описаны клиренс амилоидного бета-пептида через гематоэнцефалический барьер, способность энцефалического арбовируса пересекать тот же барьер и разрушение барьера стрептококком, ответственным за неонатальный менингит [ 81–83 ] . Если вирусы , бактерии, метастатические и воспалительные клетки могут пересекать гематоэнцефалический барьер, почему ЭДТА не может его преодолеть? Нейровоспаление у пациентов с ND связано с цитокин-зависимым увеличением проницаемости гематоэнцефалического барьера. Такое состояние, возможно, присутствует и у здоровых пациентов после патогенной инфекции. Улучшение неврологических симптомов у пациентов с ND, получавших лечение хелаторами железа, предполагает, что они могут пересекать гематоэнцефалический барьер и удалять отложения железа в мозге [ 38 ]. У EDTA молекулярная масса ниже, чем у дефероксамина, важного хелатора железа для пациентов с талассемией, и вполне возможно, что EDTA также может пересекать гематоэнцефалический барьер, особенно у пациентов с нейровоспалением. В недавней статье Louveau et al. описывают открытие лимфатической системы ЦНС (функциональные лимфатические сосуды, выстилающие синусы твердой мозговой оболочки). Эти структуры выражают все молекулярные признаки лимфатических эндотелиальных клеток, способны переносить как жидкость, так и иммунные клетки из спинномозговой жидкости и связаны с глубокими шейными лимфатическими узлами. Это открытие проливает новый свет на этиологию нейровоспалительных заболеваний и ND [ 84 ] и возможные новые терапевтические стратегии.
7. Полезность ЭДТА для хелатирования токсичных металлов
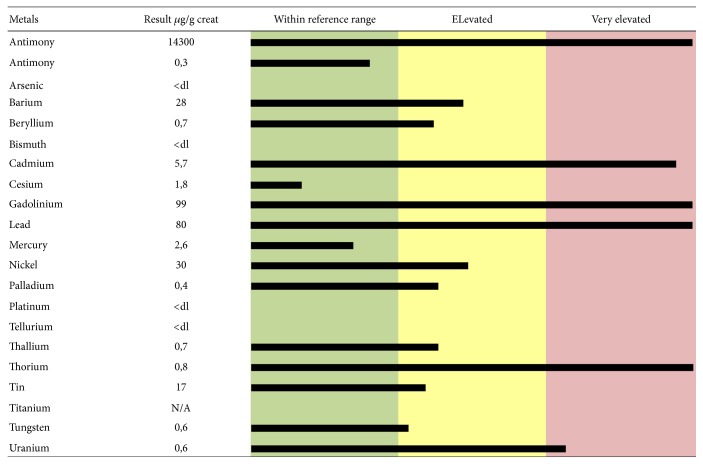
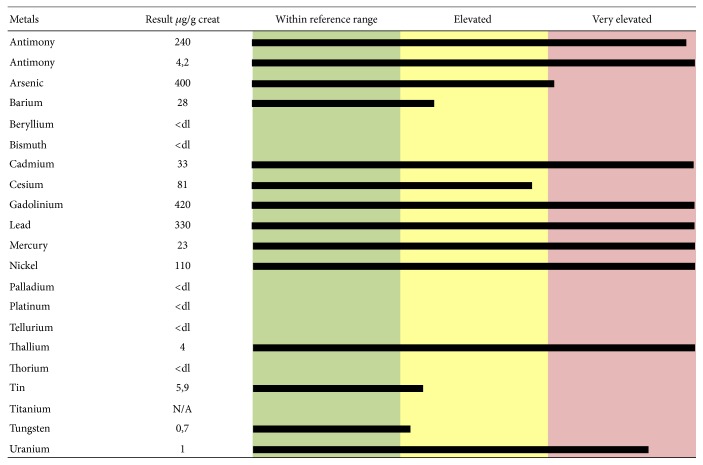
Во многих работах сообщается, что ЭДТА способна хелатировать Pb, Cd, цинк (Zn) и Ca. Хелат ЭДТА-металл растворим в воде и обычно выводится с мочой. Он может образовывать прочные ковалентные связи с металлами и увеличивать выделение с мочой. ЭДТА может хелатировать все токсичные металлы, как показано на двух минералограммах мочи, представленных в качестве примеров (рисунки 1 и 2 ). На рисунке 1 показаны значения токсичных металлов в образцах мочи, взятых после теста на хелатирование и выраженных в мкг на г креатинина, у 48-летней пациентки, страдающей рассеянным склерозом. Выделены повышенные уровни Ba, Be, Ni, Pd, Tl, Sn и W и чрезвычайно повышенные уровни Al, Cd, Gd, Pb, Th и U. На рисунке 2 показаны значения токсичных металлов в образцах мочи, взятых у 61-летнего пациента-мужчины, страдающего идиопатическим прогрессирующим спастическим парапарезом. Выделены повышенные уровни Ba, Cs, Sn и W и чрезвычайно повышенные уровни Al, Sb, As, Cd, Gd, Pb, Hg, Ni, Th и U. До воздействия ЭДТА образцы мочи не выявили наличия токсичных металлов (данные не показаны). Повышенная интоксикация (как с точки зрения самых высоких уровней токсичных металлов, так и большого количества вовлеченных токсичных металлов), показанная этими двумя пациентами, коррелирует с их серьезными клиническими проявлениями (экстремальное нарушение ходьбы, атаксия походки, спастичность ног и рук, парестезия, нарушение мелкой моторики и т. д.). Результаты, представленные более чем 1000 минералограммами мочи, показывают постоянную связь между самой высокой нагрузкой токсичными металлами и наиболее серьезными симптомами ND, которые были успешно улучшены хелатирующей терапией ЭДТА (личные неопубликованные данные).
Рисунок 1.
Уровни токсичных металлов, измеренные в моче пациента, собранной в течение 12 часов после «пробы» ЭДТА (тест хелатирования), сообщались в микрограммах ( мкг ) на г креатинина. 48-летняя пациентка страдала рассеянным склерозом.
Рисунок 2.
Уровни токсичных металлов, измеренные в моче пациента, собранной в течение 12 часов после «пробы» ЭДТА (тест хелатирования), сообщались в микрограммах ( мкг ) на г креатинина. 61-летний мужчина страдал идиопатическим прогрессирующим спастическим парапарезом.
8. Сопутствующее лечение антиоксидантами
Хелатотерапия может быть эффективно связана с ежедневным антиоксидантным лечением для улучшения эндогенной способности к детоксикации каждого пациента. Использование антиоксидантного лечения может улучшить эндогенные механизмы, наделенные антиоксидантными функциями, особенно у пациентов с ND. Антиоксидантное лечение может быть глутатионом (ультратион, 500 мг/день), отдельно или вместе с поливитаминными комплексами, аминокислотными и минеральными смесями или пробиотиками. Мы уже показали, как хелатная терапия с CaNa2 EDTA , связанная с антиоксидантным соединением Cellfood, может значительно улучшить параметры крови пациентов, страдающих ND, а также у здоровых пациентов без этого заболевания (контроль) [ 68 ]. Действительно, после трехмесячного приема хелатирования + Cellfood окисленные ЛПНП (oxLDL) снизились, уровни ROS были значительно ниже, а общая антиоксидантная емкость (TAC) и уровни глутатиона были значительно выше, чем после хелатирования + других вышеупомянутых антиоксидантных методов лечения. Более того, метаболизм гомоцистеина также улучшился в обеих группах (Cellfood и другие антиоксиданты), также продолжавшийся три месяца как у пациентов с ND, так и в контрольной группе. Cellfood (Eurodream, Специя, Италия) — это антиоксидантная пищевая добавка, содержащая 78 ионных/коллоидных микроэлементов и минералов в сочетании с 34 ферментами и 17 аминокислотами, все суспендированные в растворе сульфата дейтерия, который эффективен для защиты от повреждений in vitro [ 85 ]. В предыдущем исследовании было показано, что лечение Cellfood in vitro увеличило митохондриальный метаболизм в эндотелиальных клетках [ 86 ]. Возникает новый интерес к роли митохондрий в развитии и прогрессировании заболеваний, а также как к мишени для экологических токсинов. Дыхательная дисрегуляция связана с гибелью клеток и способствует увеличению наступления нейродегенеративных заболеваний, таких как PD и AD. Механизмы, лежащие в основе чувствительности митохондриальных дыхательных комплексов к окислительно-восстановительной модуляции, а также воздействие загрязняющих веществ окружающей среды, которые обладают митохондриальной токсичностью, были недавно изучены и обсуждены [ 87 ]. Защита митохондрий от повреждения, вызванного определенными ксенобиотиками, может быть полезным инструментом, помогающим избежать заболеваний. Отсутствие значимых исследований эффективности сопутствующего лечения с использованием хелатирующих агентов и антиоксидантов для улучшения параметров окислительного стресса у людей подчеркивает представленные результаты.
9. Заключительные замечания
Недавние исследования показывают, что хелатирование ЭДТА может быть хорошо переносимым и эффективным методом лечения пациентов, перенесших инфаркт миокарда [ 88 ]. Токсичные металлы являются загрязняющими веществами, которые могут представлять сердечно-сосудистые факторы риска и участвовать в развитии сосудистых осложнений, особенно у пациентов с диабетом [ 89 ]. Действительно, хелатирование ЭДТА может быть рекомендовано для лечения заболеваний сердца, особенно у пациентов с диабетом [ 90 ]. Токсичные металлы также играют важную роль в патогенезе ND. Было показано, что хелатирование ЭДТА улучшает неврологические симптомы у пациентов с ND [ 48 , 68 ], и результаты еще больше улучшаются при использовании антиоксидантов. Хелаторная терапия ЭДТА в дозе 2 г/неделю, медленно вводимой внутривенно взрослым, не вызывает побочных эффектов, может использоваться в течение длительного периода для облегчения как острых, так и хронических интоксикаций и способна выводить все токсичные металлы и уменьшать повреждение окислительным стрессом и воспаление в стенках кровеносных сосудов [ 50 , 51 , 60 , 65 , 73 , 90 ]. Лечение ЭДТА представляет собой важный вариант лечения НД и ССЗ, связанных с металлической нагрузкой. Не известно о взаимодействии препаратов, обычно используемых для лечения ССЗ или НД с ЭДТА.
Благодарности
Автор хотел бы поблагодарить Майкла Джона из Миланского университета Вита-Салюте за редактирование статьи на английском языке и доктора Алессандро Фулгенци за его постоянную помощь в наших экспериментальных и клинических исследованиях.
Конкурирующие интересы
Автор заявляет об отсутствии у них конкурирующих интересов.
Ссылки
- 1.Кампа М., Кастаньяс Э. Влияние загрязнения воздуха на здоровье человека. Загрязнение окружающей среды. 2008;151(2):362–367. doi: 10.1016/j.envpol.2007.06.012. [ DOI ] [ PubMed ] [ Google Scholar ]
- 2.Ядав РК, Минхас ПС, Лал К., Чатурведи РК, Ядав Г., Верма ТР Накопление металлов в почвах, грунтовых водах и съедобных частях сельскохозяйственных культур, выращиваемых при длительном орошении смешанными промышленными стоками. Бюллетень загрязнения окружающей среды и токсикологии. 2015;95(2):200–206. doi: 10.1007/s00128-015-1547-z. [ DOI ] [ PubMed ] [ Google Scholar ]
- 3.Brucker N., Moro A., Charão M. и др. Связь между металлами в крови и воспалением у водителей такси. Clinica Chimica Acta. 2015;444:176–181. doi: 10.1016/j.cca.2015.02.032. [ DOI ] [ PubMed ] [ Google Scholar ]
- 4.Фурнье П., Фуркад Ж., Ронкалли Ж., Сальвайр Р., Галинье М., Коссе Э. Гомоцистеин при хронической сердечной недостаточности. Клиническая лаборатория. 2015;61(9):1137–1145. doi: 10.7754/Clin.Lab.2015.141238. [ DOI ] [ PubMed ] [ Академия Google ]
- 5.Houston MC Роль токсичности ртути при гипертонии, сердечно-сосудистых заболеваниях и инсульте. Журнал клинической гипертонии. 2011;13(8):621–627. doi: 10.1111/j.1751-7176.2011.00489.x. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 6.Матович В., Буха А., Дукич-Чосич Д., Булат З. Взгляд на окислительный стресс, вызванный свинцом и/или кадмием в крови, печени и почках. Пищевая и химическая токсикология. 2015;78:130–140. doi: 10.1016/j.fct.2015.02.011. [ DOI ] [ PubMed ] [ Google Scholar ]
- 7.Ван Т., Фэн В., Куан Д. и др. Влияние тяжелых металлов и их взаимодействия с полициклическими ароматическими углеводородами на окислительный стресс у рабочих коксовых печей. Исследования окружающей среды. 2015;140:405–413. doi: 10.1016/j.envres.2015.04.013. [ DOI ] [ PubMed ] [ Google Scholar ]
- 8.Kasperczyk A., Dziwisz M., Ostałowska A., Świętochowska E., Birkner E. Функция печени и желчных протоков у людей, подвергшихся воздействию свинца. Human and Experimental Toxicology. 2013;32(8):787–796. doi: 10.1177/0960327112468177. [ DOI ] [ PubMed ] [ Google Scholar ]
- 9.Al-Gubory KH Загрязнители окружающей среды и факторы образа жизни вызывают окислительный стресс и плохое пренатальное развитие. Reproductive BioMedicine Online. 2014;29(1):17–31. doi: 10.1016/j.rbmo.2014.03.002. [ DOI ] [ PubMed ] [ Google Scholar ]
- 10.Schwartzbord JR, Emmanuel E., Brown DL Продукты питания и питьевая вода Гаити: обзор токсикологических рисков для здоровья. Клиническая токсикология. 2013;51(9):828–833. doi: 10.3109/15563650.2013.849350. [ DOI ] [ PubMed ] [ Google Scholar ]
- 11.Leung HM, Leung AOW, Wang HS и др. Оценка концентраций тяжелых металлов/металлоидов (As, Pb, Cd, Ni, Zn, Cr, Cu, Mn) в тканях съедобных видов рыб в дельте реки Чжуцзян (PRD), Китай. Бюллетень загрязнения морской среды. 2014;78(1-2):235–245. doi: 10.1016/j.marpolbul.2013.10.028. [ DOI ] [ PubMed ] [ Google Scholar ]
- 12.Йегамбарам М., Маниваннан Б., Бич Т.Г., Халден Р.У. Роль загрязнителей окружающей среды в этиологии болезни Альцгеймера: обзор. Current Alzheimer Research. 2015;12(2):116–146. doi: 10.2174/1567205012666150204121719. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 13.García-Esquinas E., Pérez-Gómez B., Fernández-Navarro P., et al. Свинец, ртуть и кадмий в пуповинной крови и их связь с родительскими эпидемиологическими переменными и факторами рождения. BMC Public Health. 2013;13, статья 841 doi: 10.1186/1471-2458-13-841. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 14.Sun H., Chen W., Wang D., Jin Y., Chen X., Xu Y. Влияние пренатального воздействия низких концентраций кадмия, свинца и селена на исходы родов. Chemosphere. 2014;108:33–39. doi: 10.1016/j.chemosphere.2014.02.080. [ DOI ] [ PubMed ] [ Google Scholar ]
- 15.Chen Z., Myers R., Wei T. и др. Плацентарный перенос и концентрации кадмия, ртути, свинца и селена у матерей, новорожденных и маленьких детей. Журнал Exposure Science and Environmental Epidemiology. 2014;24(5):537–544. doi: 10.1038/jes.2014.26. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 16.Zhou X., Burchiel SW, Hudson LG Резюме конференции и последние достижения: 8-я конференция по токсичности металлов и канцерогенезу. Исследования биологических микроэлементов. 2015;166:1–6. doi: 10.1007/s12011-015-0363-y. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 17.Park J.-D., Zheng W. Воздействие неорганической и элементарной ртути на человека и ее влияние на здоровье. Журнал профилактической медицины и общественного здравоохранения. 2012;45(6):344–352. doi: 10.3961/jpmph.2012.45.6.344. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 18.Скрёдер Х., Хоуксворт С., Кипплер М. и др. Функция почек и артериальное давление у детей дошкольного возраста, подвергшихся воздействию кадмия и мышьяка — потенциальное облегчение селеном. Исследования окружающей среды. 2015;140:205–213. doi: 10.1016/j.envres.2015.03.038. [ DOI ] [ PubMed ] [ Google Scholar ]
- 19.Roney N., Abadin HG, Fowler B., Pohl HR Ионы металлов, влияющие на гематологическую систему. Ионы металлов в науках о жизни. 2011;8:143–155. doi: 10.1039/9781849732116-00143. [ DOI ] [ PubMed ] [ Google Scholar ]
- 20.Kim GH, Kim JE, Rhie SJ, Yoon S. Роль окислительного стресса при нейродегенеративных заболеваниях. Experimental Neurobiology. 2015;24(4):325–340. doi: 10.5607/en.2015.24.4.325. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 21.Шафик-Ур-Рехман. Влияние свинца на перекисное окисление липидов, состав фосфолипидов и метилирование в эритроцитах человека. Biological Trace Element Research. 2013;154(3):433–439. doi: 10.1007/s12011-013-9745-1. [ DOI ] [ PubMed ] [ Google Scholar ]
- 22.Кумар В., Трипати В.К., Джахан С. и др. Синергизм свинцовой интоксикации токсических реакций, вызванных этанолом в нейрональных клетках — PC12. Молекулярная нейробиология. 2015;52(3):1504–1520. doi: 10.1007/s12035-014-8928-x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 23.Guo S., Zhou J., Chen X., et al. Эффекты наблюдателя клеток PC12, обработанных Pb2+, зависят от ROS-митохондриально-зависимой апоптотической сигнализации через щелевые контакты между клетками. Toxicology Letters. 2014;229(1):150–157. doi: 10.1016/j.toxlet.2014.05.026. [ DOI ] [ PubMed ] [ Google Scholar ]
- 24.Рейес Дж.Л., Молина-Хихон Э., Родригес-Муньос Р., Баутиста-Гарсия П., Дебрей-Гарсия Й., Наморадо MDC Белки плотных соединений и окислительный стресс при нефротоксичности, вызванной тяжелыми металлами. БиоМед Исследования Интернэшнл. 2013;2013:14. doi: 10.1155/2013/730789.730789 [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 25.Blaurock-Busch E., Busch YM, Friedle A., Buerner H., Parkash C., Kaur A. Сравнение концентрации металлов в волосах больных раком и здоровых людей, проживающих в регионе Малва в Пенджабе, Индия. Clinical Medicine Insights: Oncology. 2014;8:1–13. doi: 10.4137/CMO.S13410. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 26.Akerstrom M., Barregard L., Lundh T., Sallsten G. Связь между кадмием в почках и кадмием в моче и крови у населения, подвергающегося воздействию окружающей среды. Токсикология и прикладная фармакология. 2013;268(3):286–293. doi: 10.1016/j.taap.2013.02.009. [ DOI ] [ PubMed ] [ Google Scholar ]
- 27.Rodrigues JL, Serpeloni JM, Batista BL, Souza SS, Barbosa F., Jr. Идентификация и распределение видов ртути в тканях крыс после введения тимеросала или метилртути. Архивы токсикологии. 2010;84(11):891–896. doi: 10.1007/s00204-010-0538-4. [ DOI ] [ PubMed ] [ Google Scholar ]
- 28.Розин А. Долгосрочные последствия воздействия свинца. Журнал Израильской медицинской ассоциации. 2009;11(11):689–694. [ PubMed ] [ Google Scholar ]
- 29.Baran EJ Хелатная терапия: химическая и биохимическая перспектива. Current Medicinal Chemistry. 2010;17(31):3658–3672. doi: 10.2174/092986710793213760. [ DOI ] [ PubMed ] [ Google Scholar ]
- 30.Magliery TJ, Vitellaro LK, Diop NK, Marusak RA Fe-EDTA-бисамид и Fe-ADR-925, связанный с железом продукт гидролиза кардиопротекторного агента дексразоксана, расщепляют ДНК через гидроксильный радикал. Metal-Based Drugs. 1997;4(4):199–205. doi: 10.1155/MBD.1997.199. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 31.Fernández S., Castro P., Nogué S., Nicolás JM Острая интоксикация железом: изменение цвета мочи во время хелатной терапии дефероксамином. Intensive Care Medicine. 2014;40, статья 104 doi: 10.1007/s00134-013-3108-4. [ DOI ] [ PubMed ] [ Google Scholar ]
- 32.Аранди Н., Хагпана С., Сафаи С. и др. Комбинированная терапия — деферазирокс и дефероксамин — у пациентов с тяжелой талассемией в развивающихся странах с ограниченными ресурсами. Трансфузиологическая медицина. 2015;25(1):8–12. дои: 10.1111/tme.12188. [ DOI ] [ PubMed ] [ Академия Google ]
- 33.Songdej D., Sirachainan N., Wongwerawattanakoon P. и др. Комбинированная хелатирующая терапия с ежедневным пероральным приемом деферипрона и подкожной инфузией десфериоксамина два раза в неделю у детей с β-талассемией: 3-летний опыт. Acta Haematologica. 2015;133(2):226–236. doi: 10.1159/000363210. [ DOI ] [ PubMed ] [ Google Scholar ]
- 34.Berdoukas V., Coates TD, Cabantchik ZI Железо и окислительный стресс при кардиомиопатии при талассемии. Биология свободных радикалов и медицина. 2015;88:3–9. doi: 10.1016/j.freeradbiomed.2015.07.019. [ DOI ] [ PubMed ] [ Google Scholar ]
- 35.Wongjaikam S., Kumfu S., Chattipakorn SC, Fucharoen S., Chattipakorn N. Текущие и будущие стратегии лечения кардиомиопатии, вызванной перегрузкой железом. European Journal of Pharmacology. 2015;765:86–93. doi: 10.1016/j.ejphar.2015.08.017. [ DOI ] [ PubMed ] [ Google Scholar ]
- 36.Calvaruso G., Vitrano A., Di Maggio R., et al. Деферипрон против дефероксамина при промежуточной талассемии: результаты 5-летнего долгосрочного итальянского многоцентрового рандомизированного клинического исследования. American Journal of Hematology. 2015;90(7):634–638. doi: 10.1002/ajh.24024. [ DOI ] [ PubMed ] [ Google Scholar ]
- 37.Банерджи А., Мифсуд Н.А., Берд Р. и др. Пероральный хелатор железа деферазирокс ингибирует экспрессию генов, опосредованную NF-κB, не влияя на проксимальную активацию: последствия для миелодисплазии и апластической анемии. British Journal of Haematology. 2015;168(4):576–582. doi: 10.1111/bjh.13151. [ DOI ] [ PubMed ] [ Google Scholar ]
- 38.Ward RJ, Dexter DT, Crichton RR Нейродегенеративные заболевания и терапевтические стратегии с использованием хелаторов железа. Журнал микроэлементов в медицине и биологии. 2015;31:267–273. doi: 10.1016/j.jtemb.2014.12.012. [ DOI ] [ PubMed ] [ Google Scholar ]
- 39.Белаиди А.А., Буш А.И. Нейрохимия железа при болезни Альцгеймера и болезни Паркинсона: цели для терапии. Журнал нейрохимии. 2016;139(1):179–197. doi: 10.1111/jnc.13425. [ DOI ] [ PubMed ] [ Google Scholar ]
- 40.Devos D., Moreau C., Devedjian JC и др. Использование хелатируемого железа в качестве терапевтического метода при болезни Паркинсона. Антиоксиданты и окислительно-восстановительная сигнализация. 2014;21(2):195–210. doi: 10.1089/ars.2013.5593. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 41.Stephenson E., Nathoo N., Mahjoub Y., Dunn JF, Yong VW Железо при рассеянном склерозе: роль в нейродегенерации и восстановлении. Nature Reviews Neurology. 2014;10(8):459–468. doi: 10.1038/nrneurol.2014.118. [ DOI ] [ PubMed ] [ Google Scholar ]
- 42.Кимура Т., Онодера А., Окумура Ф., Наканиши Т., Ито Н. Трансформация, вызванная хромом (VI), усиливается дефицитом Zn в клетках BALB/c 3T3. Журнал токсикологических наук. 2015;40(3):383–387. doi: 10.2131/jts.40.383. [ DOI ] [ PubMed ] [ Google Scholar ]
- 43.Хуан Л., Ю С., Чжан Дж. и др. Экскреция металлических элементов в суточной моче у пациентов с болезнью Вильсона, лечившихся D-пеницилламином. Biological Trace Element Research. 2012;146(2):154–159. doi: 10.1007/s12011-011-9250-3. [ DOI ] [ PubMed ] [ Google Scholar ]
- 44.Xu SQ, Li XF, Zhu HY, Liu Y., Fang F., Chen L. Клиническая эффективность и безопасность хелатной терапии типичным пеницилламином в перекрестной комбинации с DMPS повторно при болезни Вильсона. Журнал университета науки и технологий Хуачжун: Медицинские науки. 2013;33:743–747. doi: 10.1007/s11596-013-1190-z. [ DOI ] [ PubMed ] [ Google Scholar ]
- 45.Рафати-Рахимзаде М., Рафати-Рахимзаде М., Каземи С., Могадамния А.А. Современные подходы к лечению отравления ртутью: потребность времени. DARU: Журнал фармацевтических наук. 2014;22, статья 46 doi: 10.1186/2008-2231-22-46. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 46.Kobayashi W., Yokokura S., Hariya T., Nakazawa T. Двухпроцентная хелатирующая этилендиаминтетрауксусная кислота для лечения полосчатой кератопатии без тупого царапания после удаления эпителия роговицы. Клиническая офтальмология. 2015;9:217–233. doi: 10.2147/opth.s75938. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 47.Exley C., Ahmed U., Polwart A., Bloor RN Повышенное содержание алюминия в моче у нынешних и бывших потребителей нелегального героина. Addiction Biology. 2007;12(2):197–199. doi: 10.1111/j.1369-1600.2007.00055.x. [ DOI ] [ PubMed ] [ Google Scholar ]
- 48.Фулгензи А., Виетти Д., Ферреро М.Е. Участие алюминия в нейротоксичности. BioMed Research International. 2014;2014:5. doi: 10.1155/2014/758323.758323 [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 49.Panariti E., Berxholi K. Токсичность свинца у людей из загрязненной муки в Албании. Ветеринарная и человеческая токсикология. 1998;40(2):91–92. [ PubMed ] [ Google Scholar ]
- 50.Hininger I., Waters R., Osman M. и др. Острые прооксидантные эффекты витамина C в хелаторной терапии с ЭДТА и долгосрочные антиоксидантные преимущества терапии. Free Radical Biology and Medicine. 2005;38(12):1565–1570. doi: 10.1016/j.freeradbiomed.2005.02.016. [ DOI ] [ PubMed ] [ Google Scholar ]
- 51.Руссель AM, Хинингер-Фавье I., Уотерс RS, Осман M., Фернхольц K., Андерсон RA Хелаторная терапия с ЭДТА без добавления витамина C снижает окислительное повреждение ДНК и перекисное окисление липидов. Обзор альтернативной медицины. 2009;14(1):56–61. [ PubMed ] [ Google Scholar ]
- 52.Мадхусудханан М., Лалл С.Б. Острое отравление свинцом у младенца. Оманский медицинский журнал. 2007;22:57–59. [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 53.Mikler J., Banovcin P., Jesenak M., Hamzikova J., Statelova D. Успешное лечение острой интоксикации свинцом. Токсикология и промышленная гигиена. 2009;25(2):137–140. doi: 10.1177/0748233709104759. [ DOI ] [ PubMed ] [ Google Scholar ]
- 54.Петракка М., Скафа Ф., Боэри Р., Флачи Д., Кандура С.М. Импортное профессиональное отравление свинцом: отчет о четырех случаях. Ла Медицина дель Лаворо. 2013;104(6):428–433. [ PubMed ] [ Академия Google ]
- 55.O'Connor ME CaEDTA против CaEDTA плюс BAL для лечения детей с повышенным уровнем свинца в крови. Клиническая педиатрия. 1992;31(7):386–390. doi: 10.1177/000992289203100701. [ DOI ] [ PubMed ] [ Google Scholar ]
- 56.Gil H.-W., Kang E.-J., Lee K.-H., Yang J.-O., Lee E.-Y., Hong S.-Y. Влияние глутатиона на хелатирование кадмия ЭДТА у пациента с кадмиевой интоксикацией. Human and Experimental Toxicology. 2011;30(1):79–83. doi: 10.1177/0960327110369818. [ DOI ] [ PubMed ] [ Google Scholar ]
- 57.Aoyama K., Nakaki T. Нарушенный синтез глутатиона при нейродегенерации. International Journal of Molecular Sciences. 2013;14(10):21021–21044. doi: 10.3390/ijms141021021. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 58.Fulgenzi A., De Giuseppe R., Bamonti F., Vietti D., Ferrero ME Эффективность хелатной терапии для устранения алюминиевой интоксикации. Журнал неорганической биохимии. 2015;152:214–218. doi: 10.1016/j.jinorgbio.2015.09.007. [ DOI ] [ PubMed ] [ Google Scholar ]
- 59.Guldager B., Brixen KT, Jorgensen SJ, Nielsen HK, Mosekilde L., Jelnes R. Влияние внутривенного введения ЭДТА на уровень паратиреоидного гормона в сыворотке (1-84) и биохимические маркеры метаболизма костной ткани. Датский медицинский вестник. 1993;40(5):627–630. [ PubMed ] [ Google Scholar ]
- 60.Lamas GA, Goertz C., Boineau R. и др. Влияние режима хелатирования динатриевой ЭДТА на сердечно-сосудистые события у пациентов с перенесенным инфарктом миокарда: рандомизированное исследование TACT. Журнал Американской медицинской ассоциации. 2013;309(12):1241–1250. doi: 10.1001/jama.2013.2107. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 61.Lamas GA, Boineau R., Goertz C. и др. Хелаторная терапия с ЭДТА отдельно и в сочетании с пероральными высокими дозами поливитаминов и минералов при ишемической болезни сердца: результаты факторной группы исследования по оценке хелатной терапии. American Heart Journal. 2014;168(1):37–44.e5. doi: 10.1016/j.ahj.2014.02.012. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 62.Solenkova NV, Newman JD, Berger JS, Thurston G., Hochman JS, Lamas GA Металлические загрязнители и сердечно-сосудистые заболевания: механизмы и последствия воздействия. American Heart Journal. 2014;168(6):812–822. doi: 10.1016/j.ahj.2014.07.007. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 63.Moon KA, Guallar E., Umans JG и др. Связь между воздействием низких и умеренных уровней мышьяка и сердечно-сосудистыми заболеваниями. Проспективное когортное исследование. Annals of Internal Medicine. 2013;159(10):649–659. doi: 10.7326/0003-4819-159-10-201311190-00719. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 64.Tellez-Plaza M., Guallar E., Howard BV и др. Воздействие кадмия и сердечно-сосудистые заболевания. Эпидемиология. 2013;24(3):421–429. doi: 10.1097/EDE.0b013e31828b0631. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 65.Ouyang P., Gottlieb SH, Culotta VL, Navas-Acien A. Хелаторная терапия с ЭДТА для снижения сердечно-сосудистых событий у лиц с диабетом. Current Cardiology Reports. 2015;17(11, статья 96) doi: 10.1007/s11886-015-0656-y. [ DOI ] [ PubMed ] [ Google Scholar ]
- 66.Chin-Chan M., Navarro-Yepes J., Quintanilla-Vega B. Загрязнители окружающей среды как факторы риска нейродегенеративных расстройств: болезни Альцгеймера и Паркинсона. Frontiers in Cellular Neuroscience. 2015;9, статья 124 doi: 10.3389/fncel.2015.00124. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 67.Carocci A., Rovito N., Sinicropi MS, Genchi G. Токсичность ртути и нейродегенеративные эффекты. Обзоры загрязнения окружающей среды и токсикологии. 2014;229:1–18. doi: 10.1007/978-3-319-03777-6_1. [ DOI ] [ PubMed ] [ Google Scholar ]
- 68.Fulgenzi A., De Giuseppe R., Bamonti F., Ferrero ME Улучшение окислительных и метаболических параметров путем введения клеточного питания у пациентов, страдающих нейродегенеративными заболеваниями при лечении хелаторами. BioMed Research International. 2014;2014:9. doi: 10.1155/2014/281510.281510 [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 69.Чабаркапа А., Борозан С., Живкович Л. и др. Хелатирование CaNa2EDTA ослабляет повреждение клеток у рабочих, подвергшихся воздействию свинца — пилотное исследование. Химико-биологические взаимодействия. 2015;242:171–178. doi: 10.1016/j.cbi.2015.10.002. [ DOI ] [ PubMed ] [ Google Scholar ]
- 70.Mosayebi G., Haghmorad D., Namaki S., Ghazavi A., Ekhtiari P., Mirshafiey A. Терапевтический эффект ЭДТА в экспериментальной модели рассеянного склероза. Иммунофармакология и иммунотоксикология. 2010;32(2):321–326. doi: 10.3109/08923970903338367. [ DOI ] [ PubMed ] [ Google Scholar ]
- 71.Ян С.-К., Сяо Л., Сун П.-А., Сюй Х.-Х., Лю Ф.-Й., Сан Л. Эффективна ли хелатирующая терапия свинцом при хронической болезни почек? Метаанализ. Нефрология. 2014;19(1):56–59. doi: 10.1111/nep.12162. [ DOI ] [ PubMed ] [ Google Scholar ]
- 72.Санчес-Фруктуосо А.И., Бланко Х., Кано М. и др. Экспериментальная свинцовая нефропатия: лечение динатриевым этилендиаминтетраацетатом кальция. Американский журнал почечных заболеваний. 2002;40(1):59–67. doi: 10.1053/ajkd.2002.33936. [ DOI ] [ PubMed ] [ Google Scholar ]
- 73.Foglieni C., Fulgenzi A., Ticozzi P., et al. Защитный эффект предварительного введения ЭДТА при почечной ишемии. BMC Nephrology. 2006;7, статья 5 doi: 10.1186/1471-2369-7-5. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 74.Chen K.-H., Lin J.-L., Lin-Tan D.-T., et al. Влияние хелаторной терапии на прогрессирующую диабетическую нефропатию у пациентов с диабетом 2 типа и высоким нормальным содержанием свинца в организме. Американский журнал почечных заболеваний. 2012;60(4):530–538. doi: 10.1053/j.ajkd.2012.04.028. [ DOI ] [ PubMed ] [ Google Scholar ]
- 75.Huang W.-H., Lin J.-L., Lin-Tan D.-T., Hsu C.-W., Chen K.-H., Yen T.-H. Воздействие свинца в окружающей среде ускоряет прогрессирование диабетической нефропатии у пациентов с диабетом II типа. BioMed Research International. 2013;2013:9. doi: 10.1155/2013/742545.742545 [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 76.Lin-Tan D.-T., Lin J.-L., Yen T.-H., Chen K.-H., Huang Y.-L. Долгосрочные результаты повторной свинцовой хелаторной терапии при прогрессирующих недиабетических хронических заболеваниях почек. Nephrology Dialysis Transplantation. 2007;22(10):2924–2931. doi: 10.1093/ndt/gfm342. [ DOI ] [ PubMed ] [ Google Scholar ]
- 77.Lin J.-L., Lin-Tan D.-T., Hsu K.-H., Yu C.-C. Воздействие свинца в окружающей среде и прогрессирование хронических заболеваний почек у пациентов без диабета. The New England Journal of Medicine. 2003;348(4):277–286. doi: 10.1056/NEJMoa021672. [ DOI ] [ PubMed ] [ Google Scholar ]
- 78.Lin J.-L., Lin-Tan D.-T., Yu C.-C., Li Y.-J., Huang Y.-Y., Li K.-L. Воздействие свинца на окружающую среду и прогрессирующая диабетическая нефропатия у пациентов с диабетом II типа. Kidney International. 2006;69(11):2049–2056. doi: 10.1038/sj.ki.5001505. [ DOI ] [ PubMed ] [ Google Scholar ]
- 79.Саболич И. Общие механизмы нефропатии, вызванной токсичными металлами. Nephron—Physiology. 2006;104(3):107–114. doi: 10.1159/000095539. [ DOI ] [ PubMed ] [ Google Scholar ]
- 80.Лосинский А.С., Шиверс Р.Р. Структурные пути макромолекулярного и клеточного транспорта через гематоэнцефалический барьер при воспалительных состояниях. Обзор. Гистология и гистопатология. 2004;19(2):535–564. doi: 10.14670/HH-19.535. [ DOI ] [ PubMed ] [ Google Scholar ]
- 81.Deane R., Bell RD, Sagare A., Zlokovic BV Клиренс амилоидного пептида β через гематоэнцефалический барьер: значение для терапии болезни Альцгеймера. CNS and Neurological Disorders-Drug Targets. 2009;8(1):16–30. doi: 10.2174/187152709787601867. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 82.Ferguson MC, Saul S., Fragkoudis R. и др. Способность энцефалитического арбовируса леса Семлики пересекать гематоэнцефалический барьер определяется зарядом гликопротеина E2. Journal of Virology. 2015;89(15):7536–7549. doi: 10.1128/JVI.03645-14. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 83.Kim BJ, Hancock BM, Bermudez A. и др. Бактериальная индукция Snail1 способствует нарушению гематоэнцефалического барьера. Журнал клинических исследований. 2015;125(6):2473–2483. doi: 10.1172/JCI74159. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 84.Louveau A., Smirnov I., Keyes TJ, et al. Структурные и функциональные особенности лимфатических сосудов центральной нервной системы. Nature. 2015;523(7560):337–341. doi: 10.1038/nature14432. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 85.Benedetti S., Catalani S., Palma F., Canestrari F. Антиоксидантная защита CELLFOOD® от окислительного повреждения in vitro. Пищевая и химическая токсикология. 2011;49(9):2292–2298. doi: 10.1016/j.fct.2011.06.029. [ DOI ] [ PubMed ] [ Google Scholar ]
- 86.Ferrero E., Fulgenzi A., Belloni D., Foglieni C., Ferrero ME Cellfood™ улучшает дыхательный метаболизм эндотелиальных клеток и подавляет генерацию активных форм кислорода (ROS), вызванную гипоксией. Журнал физиологии и фармакологии. 2011;62(3):287–293. [ PubMed ] [ Google Scholar ]
- 87.Caito SW, Aschner M. Митохондриальная окислительно-восстановительная дисфункция и воздействие окружающей среды. Антиоксиданты и окислительно-восстановительная сигнализация. 2015;23(6):578–595. doi: 10.1089/ars.2015.6289. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 88.Avila MD, Escolar E., Lamas GA Хелатотерапия после испытания по оценке хелатной терапии: результаты уникального испытания. Current Opinion in Cardiology. 2014;29(5):481–488. doi: 10.1097/hco.00000000000000096. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 89.Peguero JG, Arenas I., Lamas GA Хелатотерапия и сердечно-сосудистые заболевания: объединение научных разрозненных источников для пользы кардиологических пациентов. Тенденции в сердечно-сосудистой медицине. 2014;24:232–240. doi: 10.1016/j.tcm.2014.06.002. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]
- 90.Lamas GA Cardiology Patient Page. Хелатная терапия: новый взгляд на старое лечение заболеваний сердца, особенно у диабетиков. Circulation. 2015;131(21):e505–e506. doi: 10.1161/circulationaha.114.010774. [ DOI ] [ Бесплатная статья PMC ] [ PubMed ] [ Google Scholar ]